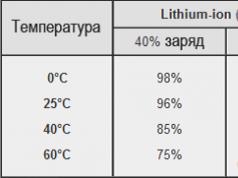
Oxid de mangan (II).- MnO - oxid de mangan inferior, monoxid.
Oxid de bază. Insolubil în apă. Se oxidează cu ușurință pentru a forma o coajă fragilă de MnO2. Redus la mangan atunci când este încălzit cu hidrogen sau metale active.
Oxidul de mangan (II) poate fi obținut prin calcinarea sărurilor de mangan (II) care conțin oxigen la o temperatură de 300 ° C într-o atmosferă de gaz inert. Se obține din MnO 2 larg răspândit prin reducerea parțială la temperaturi de 700-900 ° C cu hidrogen sau monoxid de carbon.
Hidroxid de mangan (II).- compus anorganic, hidroxid de mangan metalic cu formula Mn (OH) 2, cristale roz deschis, insolubil în apă. Prezintă proprietăți de bază slabe. Se oxidează în aer.
Hidroxidul de mangan (II) se formează prin interacțiunea sărurilor sale cu alcalii:
Proprietăți chimice.
Hidroxidul de mangan (II) este ușor oxidat în aer până la oxohidroxid de mangan maro, care se descompune în continuare în oxid de mangan (IV):
· Hidroxidul de mangan (II) are proprietăți de bază. Reacționează cu acizi și oxizi acizi:
· Hidroxidul de mangan (II) are proprietăți reducătoare. În prezența oxidanților puternici, poate fi oxidat la permanganat:
Oxid de mangan (III).- compus anorganic, oxid de mangan metalic cu formula Mn 2 O 3, cristale brun-negru, insolubil în apă.
Primirea.
· Minerale naturale brownit, kurnakite și bixbyit - oxid de mangan cu diverse impurități.
Oxidarea oxidului de mangan (II):
Reducerea oxidului de mangan (IV):
Proprietăți chimice.
Se descompune la încălzire:
Când este dizolvat în acizi, este disproporționat:
Când fuziunea cu oxizi metalici formează săruri de manganit:
Nu se dizolvă în apă.
Hidroxid de mangan (III). –Mn2O3ּ H2O sau MnO (OH) apare în mod natural ca mineral manganit(minereu de mangan brun). Hidroxidul de mangan (III) obținut artificial este folosit ca vopsea negru-maro.
Când interacționează cu oxidanții acizi, săruri de mangan.
Sărurile de mangan (II), de regulă, sunt ușor solubile în apă, cu excepția Mn 3 (PO 4) 2, MnS, MnCO 3.
Sulfat de mangan(II) MnSO4 este o sare albă, unul dintre cei mai stabili compuși de mangan (II). Sub formă de hidrat cristalin MnSO 4 7H 2 O apare în natură. Este folosit pentru vopsirea țesăturilor, precum și împreună cu clorura de mangan (II) MnCl 2 - pentru a obține alți compuși de mangan.
Carbonat de mangan(II) MnCO3 se găsește în mod natural sub formă de pulbere de mangan și este utilizat în metalurgie.
Nitrat de mangan(II) Mn (NO 3) 2 se obține numai artificial și este utilizat pentru separarea metalelor pământurilor rare.
Sărurile de mangan sunt catalizatori pentru procesele oxidative care implică oxigen. Sunt folosite în desicanti. Uleiul din semințe de in cu adăugarea unui astfel de desicant se numește ulei de uscare.
Oxid de mangan (IV). (dioxid de mangan) MnO 2 este o pulbere maro închis, insolubilă în apă. Cel mai stabil compus de mangan, răspândit în scoarța terestră (mineral piroluzit).
Proprietăți chimice.
În condiții normale, se comportă destul de inert. Când este încălzit cu acizi, prezintă proprietăți oxidante, de exemplu, oxidează acidul clorhidric concentrat la clor:
Cu acizii sulfuric și azotic, MnO 2 se descompune odată cu eliberarea de oxigen:
Când interacționează cu oxidanți puternici, dioxidul de mangan este oxidat la compușii Mn 7+ și Mn 6+:
Dioxidul de mangan prezintă proprietăți amfotere. Deci, atunci când o soluție de acid sulfuric de sare de MnSO 4 este oxidată cu permanganat de potasiu în prezența acidului sulfuric, se formează un precipitat negru de sare de Mn (SO 4) 2.
Și la fuziunea cu alcaline și oxizi bazici, MnO 2 acționează ca un oxid acid, formând săruri - manganiți:
Este un catalizator pentru descompunerea peroxidului de hidrogen:
Primirea.
În condiții de laborator, ele sunt obținute prin descompunerea termică a permanganatului de potasiu:
Poate fi obținut și prin reacția permanganatului de potasiu cu peroxid de hidrogen. În practică, MnO2 format descompune catalitic peroxidul de hidrogen, drept urmare reacția nu se desfășoară până la sfârșit.
La temperaturi peste 100 ° C, reducerea permanganatului de potasiu cu hidrogen:
64. Compuși ai manganului (VI), metode de producție și proprietăți. Oxid de mangan (VII), acid permanganic și permanganați - preparare, proprietăți, aplicare.
Oxid de mangan (VI).- un compus anorganic, oxidul de mangan metalic cu formula MnO 3, o substanta amorfa rosu inchis care reactioneaza cu apa.
Format prin condensarea vaporilor violet eliberați atunci când o soluție de permanganat de potasiu în acid sulfuric este încălzită:
Proprietăți chimice.
Se descompune la încălzire:
Reactioneaza cu apa:
Formează săruri cu alcalii - manganați:
Hidroxid de mangan (VI). prezintă un caracter acid. Acidul de mangan liber (VI) este instabil și disproporționat într-o soluție apoasă conform schemei:
3H2Mn04(c) → 2HMn04(c) + Mn02(s) + 2H20 (l).
Manganați (VI) se formează prin fuziunea dioxidului de mangan cu alcalii în prezența oxidanților și au o culoare verde smarald. Într-un mediu puternic alcalin, manganații (VI) sunt destul de stabili. La diluarea soluțiilor alcaline are loc hidroliza, însoțită de disproporționare:
3K2MnO4(c) + 2H2O (l) → 2KMn04(c) + Mn02(s) + 4KOH (c).
Manganații (VI) sunt oxidanți puternici, care se reduc în mediu acid la Mn (II), iar în medii neutre și alcaline – până la MnO2. Sub acțiunea oxidanților puternici, manganații (VI) pot fi oxidați la Mn (VII):
2K2MnO4(c) + CI2(g) → 2KMn04(c) + 2KCI (c).
Când este încălzit peste 500 ° C, manganatul (VI) se descompune în produse:
manganat (IV) și oxigen:
2K 2 MnO 4 (s) → K 2 MnO 3 (s) + O 2 (g).
Oxid de mangan (VII) Mn2O7- lichid uleios brun-verzui (t pl = 5,9 ° C), instabil la temperatura camerei; agent oxidant puternic, in contact cu substantele combustibile le aprinde, eventual cu o explozie. Explodează dintr-un șoc, dintr-un fulger strălucitor de lumină, atunci când interacționează cu substanțe organice. Oxidul de mangan (VII) Mn 2 O 7 poate fi obținut prin acțiunea acidului sulfuric concentrat asupra permanganatului de potasiu:
Oxidul de mangan (VII) rezultat este instabil și se descompune în oxid de mangan (IV) și oxigen:
Ozonul este eliberat simultan:
Oxidul de mangan (VII) reacționează cu apa pentru a forma acid manganic, care are o culoare roșu-violet:
Acidul permanganic anhidru nu a putut fi obținut; în soluție este stabil până la o concentrație de 20%. Acest acid foarte puternic, gradul aparent de disociere într-o soluție cu o concentrație de 0,1 mol/dm 3 este egal cu 93%.
Acid permanganic – agent oxidant puternic . Interacționează și mai energetic Mn2O7, substanțele combustibile se aprind la contactul cu acesta.
Sărurile acidului manganic se numesc permanganați ... Cel mai important dintre acestea este permanganatul de potasiu, care este un agent oxidant foarte puternic. Proprietățile sale oxidante față de substanțele organice și anorganice sunt adesea întâlnite în practica chimică.
Gradul de reducere a ionului de permanganat depinde de natura mediului:
1) mediu acid Mn (II) (Mn 2+ săruri)
MnO 4 - + 8H + + 5ē = Mn 2+ + 4H 2 O, E 0 = +1,51 B
2) mediu neutru Mn (IV) (oxid de mangan (IV))
MnO 4 - + 2H 2 O + 3ē = MnO 2 + 4OH -, E 0 = +1,23 B
3) mediu alcalin Mn (VI) (manganați M 2 MnO 4)
MnO 4 - + ē = MnO 4 2-, E 0 = + 0,56B
După cum se poate observa, permanganații prezintă cele mai puternice proprietăți oxidante într-un mediu acid.
Manganații se formează într-o soluție foarte alcalină care suprimă hidroliza K2MnO4... Deoarece reacția are loc de obicei în soluții suficient de diluate, produsul final al reducerii permanganatului într-un mediu alcalin, precum și într-un mediu neutru, este MnO 2 (vezi disproporționarea).
La o temperatură de aproximativ 250 ° C, permanganatul de potasiu se descompune conform următoarei scheme:
2KMnO 4 (s) K 2 MnO 4 (s) + MnO 2 (s) + O 2 (g)
Permanganatul de potasiu este folosit ca antiseptic. Soluțiile apoase din diferitele sale concentrații de la 0,01 la 0,5% sunt utilizate pentru dezinfecția rănilor, gargară și alte proceduri antiinflamatorii. Cu succes se folosesc 2 - 5% soluții de permanganat de potasiu pentru arsurile pielii (pielea se usucă, iar vezica urinară nu se formează). Pentru organismele vii, permanganații sunt otrăvuri (determină coagularea proteinelor). Neutralizarea lor se realizează cu o soluție de 3%. H2O2 acidulat cu acid acetic:
2KMnO 4 + 5H 2 O 2 + 6CH 3 COOH → 2Mn (CH 3 COO) 2 + 2CH 3 COOK + 8H 2 O + 5O 2
65. Compuși ai reniului (II), (III), (VI). Compuși ai reniului (VII): oxid, acid renic, perrenați.
Oxid de reniu (II).- compus anorganic, oxid de reniu metalic cu formula ReO, cristale negre, insolubile in apa, formeaza hidrati.
Oxidul de reniu hidrat ReO H 2 O se formează prin reducerea acidului renic cu cadmiu într-un mediu acid:
Oxid de reniu (III).- compus anorganic, oxid de reniu metalic cu formula Re 2 O 3, pulbere neagră, insolubilă în apă, formează hidrați.
Primit prin hidroliza clorurii de reniu (III) într-un mediu alcalin:
Se oxidează ușor în apă:
Oxid de reniu (VI).- compus anorganic, oxid de reniu metalic cu formula ReO 3, cristale roșu închis, insolubil în apă.
Primirea.
Proporția oxidului de reniu (VII):
Reducerea oxidului de reniu (VII) cu monoxid de carbon:
Proprietăți chimice.
Se descompune la încălzire:
Oxidat cu acid azotic concentrat:
Formează reniți și perrenați cu hidroxizi de metale alcaline:
Oxidată de oxigenul atmosferic:
Redus de hidrogen:
Oxid de reniu (VII).- un compus anorganic, oxidul de reniu metalic cu formula Re 2 O 7, cristale higroscopice galben deschis, se dizolva in apa rece, reactioneaza cu apa fierbinte.
Primirea.
Oxidarea reniului metalic:
Descompunerea la încălzirea oxidului de reniu (IV):
Oxidarea oxidului de reniu (IV):
Descompunerea la încălzirea acidului renic:
Proprietăți chimice.
Se descompune la încălzire:
Reactioneaza cu apa fierbinte:
Reacționează cu alcalii pentru a forma perrenați:
· Este un agent oxidant:
Redus de hidrogen:
În proporție cu reniu:
Reacţionează cu monoxidul de carbon:
Acid renic- un compus anorganic, un acid care conține oxigen cu formula HReO 4, există numai în soluții apoase, formează săruri perrenates.
Transferul reniului din compușii slab solubili, cum ar fi ReO și ReS2, în soluție se realizează prin descompunere acidă sau fuziune alcalină cu formarea de perrenați solubili sau acid perrenic. Și invers, extracția reniului din soluții se realizează prin precipitare sub formă de perrenați de potasiu, cesiu, taliu, etc. De mare importanță industrială este perrenatul de amoniu, din care se obține reniul metalic prin reducere cu hidrogen.
Acidul renic se obține prin dizolvarea Re2O7 în apă:
Re2O7 + H2O = 2HReO4.
Soluțiile de acid renic se obțin și prin dizolvarea reniului metalic în peroxid de hidrogen, apă bromică și acid azotic. Excesul de peroxid este îndepărtat prin fierbere. Acidul renic se obține prin oxidarea oxizilor și sulfurilor inferioare, din perrenați folosind schimbul de ioni și electrodializă. Pentru comoditate, Tabelul 2 prezintă valorile densităților soluțiilor de acid renic.
Acidul renic este stabil. Spre deosebire de acizii percloric și manganic, are proprietăți oxidante foarte slabe. Recuperarea sa este de obicei lentă. Amalgamurile metalice și agenții chimici sunt utilizați ca agenți reducători.
Perrenații sunt mai puțin solubili și mai stabili din punct de vedere termic decât perclorații și permanganații corespunzători.
Cei mai puțin solubili perrenați sunt taliu, cesiu, rubidiu și potasiu.
Perrenați Tl, Rb, Cs, K, Ag - substanțe slab solubile, perrenați, Ba, Pb (II) au solubilitate medie, perrenați Mg, Ca, Cu, Zn, Cd etc. foarte bine solubil in apa. În compoziția perrenaților de potasiu și amoniu, reniul este eliberat din soluțiile industriale.
Perrenat de potasiu KReO4 - mici cristale hexagonale incolore. Se topește fără descompunere la 555 °, la o temperatură mai mare se volatilizează, disociându-se parțial. Solubilitatea sării într-o soluție apoasă de acid renic este mai mare decât în apă, în timp ce în prezența H2SO4 practic nu se modifică.
Perrenatul de amoniu NH4ReO4 se obţine prin neutralizarea acidului perrenic cu amoniac. Este relativ bine solubil în apă. La cristalizarea din soluții, formează soluții solide continue cu KReO4. Când este încălzit în aer, se descompune, începând de la 200 °, dând un sublimat care conține Re2O7 și un reziduu negru de ReO2. Când este descompus într-o atmosferă inertă, numai oxidul de reniu (IV) se formează prin reacția:
2NH4ReO4 = 2ReO2 + N2 + 4H2O.
Când sarea este redusă cu hidrogen, se obține un metal.
Dintre sărurile acidului renic cu baze organice, remarcăm perrenatul de nitronă C20H17N4ReO4, care are o solubilitate foarte scăzută în soluții de acetat, mai ales în prezența unui exces de acetat de nitronă. Formarea acestei săruri este utilizată pentru determinarea cantitativă a reniului.
Compuși de mangan. Oxizi, hidroxizi. Acid permanganic. Permanganat de potasiu, proprietățile sale oxidante în medii acide, neutre și alcaline.
Compuși de mangan. Oxizi, hidroxizi.
Manganul formează mai mulți oxizi. Cele mai stabile sunt
МnО Мn2O3 МnO2 Мn2O7
Oxid de mangan (VII) Mn2O7 - un lichid uleios de culoare negru-verde peste 50 ° С se descompune cu formarea de oxigen și oxizi inferiori, la o temperatură mai mare explodează:
2Mn2O7 = 4MnO2 + 3O2.
Prezintă proprietăți acide. Reacționează cu apa pentru a forma acid permanganic:
Mn2O7 + H2O = 2HMnO4.
Oxidul de mangan poate fi obținut doar indirect:
2KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O.
Acidul permanganic este un acid puternic foarte instabil, se descompune deja peste 3 ° C:
4HMnO4 = 4MnO2 + 2H2O + 3O2.
Oxidul de mangan (II) MnO și hidroxizii corespunzători Mn (OH) 2 sunt substanțe bazice.
Οʜᴎ interacționează cu acizii pentru a forma săruri de mangan (II).
MnO + 2HCI = MnCl2 + 2H2O
Mn (OH)2 + 2HCI = MnCI2 + 2H2O
Mn (OH) 2 se obţine prin acţiunea alcalinelor asupra sărurilor Mn2 + solubile
MnCl2 + 2NaOH = Mn (OH) 2 ↓ + 2Н2O
Mn2 + + 2OH- = Mn (OH) 2 ↓
sediment alb
Din cauza instabilității, Mn (OH) 2 este deja oxidat în aer, formând Mn (OH) 4
2Mn (OH) 2 + О2 + 2Н2O = 2Mn (OH) 4
Această reacție este calitativă pentru cationul Mn2 +
Q-oxid de mangan (IV), sau dioxid de mangan, MnO2 și hidroxid Mn (OH) 4- substanțe amfotere.
Când MnO2 interacționează cu acidul sulfuric, se formează sulfat de mangan (IV) instabil
МnО2 + 2H2SO4 = Mn (SO4) 2 + 2 Н2O
Când MnO2 este fuzionat cu alcalii, reacția continuă cu formarea manganiților (IV), care ar trebui considerate săruri ale acidului permangan Н4MnO4.
МnО2 + 4KОН = K4MnO4 + 2Н2O
Oxidul de mangan (IV), pe baza substanțelor cu care reacționează, poate prezenta proprietățile atât ale unui agent oxidant, cât și ale unui agent reducător.
4HCI + MnO2 = MnCl2 + CI2 + 2H2O
2МnO2 + ЗРbО2 + 6НNО3 = 2НМnО4 + ЗРb (NO3) 2 + 2 Н2O
În prima reacție, МnО2 acționează ca un agent de oxidare, în a doua - ca un agent reducător.
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, în seria oxizilor și hidroxizilor de mangan cu diferite stări de oxidare apare un model general: cu creșterea stării de oxidare, caracterul de bază al oxizilor de hidroxid se slăbește, iar caracterul acid crește.
Sărurile acidului permanganic se numesc permanganați.
Cea mai cunoscută sare este permanganatul de potasiu KMnO4 - o substanță cristalină violet închis, moderat solubilă în apă. Soluțiile de KMnO4 au o culoare purpurie închisă, iar la concentrații mari - violete, caracteristice anionilor MnO4-.
Permanganatul de potasiu se descompune atunci când este încălzit
2KMnO4 = K2MnO4 + MnO2 + O2
Permanganatul de potasiu este un agent oxidant foarte puternic, oxidează cu ușurință multe substanțe anorganice și organice. Gradul de reducere a manganului este foarte dependent de pH-ul mediului.
Sărurile acidului manganic - permanganați - conțin ionul permanganat MnO4- în soluție, sunt de culoare violet. Arată proprietăți oxidante, compușii de mangan (II) se formează într-un mediu acid:
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
în neutru - mangan (IV):
2KMnO4 + 3K2SO3 + H2O = 2MnO2 + 3K2SO4 + 2KOH
în alcalin - mangan (VI):
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2O
Când este încălzit, se descompune:
2KMnO4 = K2MnO4 + MnO2 + O2.
Permanganatul de potasiu se obține conform următoarei scheme:
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O;
apoi manganatul este transformat în permanganat prin oxidare electrochimică, ecuația generală a procesului este:
2K2MnO4 + 2H2O = 2KMnO4 + 2KOH + H2.
Compuși de mangan. Oxizi, hidroxizi. Acid permanganic. Permanganat de potasiu, proprietățile sale oxidante în medii acide, neutre și alcaline. - concept și tipuri. Clasificarea și caracteristicile categoriei "Compuși mangan. Oxizi, hidroxizi. Acid manganic. Permanganat de potasiu, proprietățile sale oxidante în medii acide, neutre și alcaline." 2017, 2018.
Autor Enciclopedie chimică b. I.L. KnunyantsOXID DE MANGAN: MnO, Mn2O3, Mn02, Mn3O4, Mn2O7, Mn5O8. Cu excepția Mn 2 O 7, toți oxizii sunt cristale, insolubile în apă. Când oxizii superiori sunt încălziți, О 2 este despărțit și se formează oxizi inferiori:
Când sunt ținute în aer sau într-o atmosferă de O 2 peste 300 ° C, MnO și Mn 2 O 3 sunt oxidate la MnO 2.
Anhidru și hidratat. Oxizii de Mn fac parte din minereurile de mangan și fier-mangan sub formă de minerale piroluzite b-MnO2, psilomelan mMO * nMnO 2 * xH 2 O [M = Ba, Ca, K, Mn (H)], manganit b -MnOOH ( Mn 2 О 3 * Н 2 О), growit g -MnOOH, brownit 3Mn 2 O 3 * MnSiO 3 etc. cu un continut de MnO 2 de 60-70%. Prelucrarea minereurilor de mangan include concentrarea umedă și separarea chimică ulterioară a oxizilor MnO 2 sau Mn 2 O 3 prin metode de sulfitizare și sulfatare, carbonizare și reducere. prăjire etc.
Monoxid de MnO (mineral manganit). Hexagonul este stabil până la - 155,3 ° С. modificare, deasupra - cubic (vezi tabel). Semiconductor. Antiferomagnet cu un punct Neel de 122 K; magn. susceptibilitate + 4,85 * 10 - 3 (293 K). Are proprietăți de bază slabe; redus la Mn cu hidrogen și metale active la încălzire. Când MnO interacționează cu acizii, se formează săruri de Mn (II), cu NaOH topit la 700-800°C și un exces de O 2 - Na 3 MnO 4, sub acțiunea sulfurei (NH 4) 2 S - MnS. Obținut prin descompunerea Mn (OH) 2, Mn (C 2 O 4), Mn (NO 3) 2 sau MnCO 3 în atmosferă inertă la 300 ° C, controlată prin reducerea MnO 2 sau Mn 2 O 3 cu hidrogen sau CO la 700-900 ° CU. Componentă de ferită și alte ceramice materiale, zgura pentru desulfurarea metalelor, ingrasaminte cu micronutrienti, catalizator de dehidrogenare piperidinica, antiferomagnet. material.
Sesquioxidul Mn 2 O 3 există în două modificări - rombic. a (kurnakite minerală) și cubic. b (bixbyit mineral), temperatura de tranziție a : b 670 ° C; paramagnetic, magn. susceptibilitate +1,41 10 - 5 (293 K); H2 este redus la 300°C la MnO, cu aluminiu atunci când este încălzit la Mn.

Sub acțiunea H2SO4 și HNO3 diluate, se transformă în MnO2 și sarea Mn (II). Obține Mn 2 Aproximativ 3 descompunere termodinamică a MnOOH.
Oxid de mangan (II, III) Mn 3 O 4 (hausmanit mineral); a -Mn 3 Aproximativ 4 la 1160 ° C intră în b-Mn 3 Aproximativ 4 cu cristalin cubic. zăbrele; D H 0 tranziție a : b 20,9 kJ/mol; paramagnetic, magn. susceptibilitate + 1,24 * 10 - 5 (298 K). Arată proprietățile chimice inerente MnO și Mn 2 O 3.
Dioxidul MnO 2 este compusul Mn cel mai abundent din natură; cea mai stabilă este b-modificarea (mineral piroluzit). Rombul este cunoscut. g -MnO 2 (mineralul ramsdelit, sau polianit), precum și a, d și e, considerate ca soluții solide de diferite forme de MnO 2. Paramagnet, magnet. susceptibilitate + 2,28 * 10 - 3 (293 K). Dioxid de Mn - nestoichiometric compus, există întotdeauna o lipsă de oxigen în rețeaua sa. Amfoterină. H2 este redus la MnO la 170°C. Când interacționează cu NH3, se formează H2O, N2 și Mn2O3. Sub acțiunea О 2 în topitură, NaOH dă Na 2 MnO 4, într-un conc. acizi - sărurile corespunzătoare ale Mn (IV), H 2 O şi O 2 (sau Cl 2 în cazul acidului clorhidric). MnO 2 se obține prin descompunerea Mn (NO 3) 2 sau Mn (OH) 2 la 200 ° C în aer, reducerea KMnO 4 în mediu neutru, electroliza sărurilor Mn (II). Folosit pentru obținerea Mnului și a compusului său, desicanți, ca depolarizant în elementele uscate, o componentă de pigment brun (umber) pentru vopsele, pentru a lumina sticla, ca reactiv pentru detectarea Cl -, agent oxidant în hidrometalurgia Zn, Cu, U, component catalizator din cartușele de hopcalit și altele.MnO 2 activ, obținut prin interacțiunea soluțiilor apoase de MnSO 4 și KMnO 4, este un agent oxidant în chimia organică.
Oxid de mangan (VII) Mn 2 O 7 (heptaoxid de dimargan, anhidridă de mangan) - lichid verde uleios; punct de topire 5,9 ° C; densitate 2,40 g/cm3; Proba D H 0 -726,3 kJ/mol. Peste 50 ° C, cu încălzire lentă, începe să se descompună odată cu eliberarea de O 2 și formarea de oxizi inferiori și explodează la temperaturi mai mari sau viteze de încălzire ridicate; extrem de sensibil la influenţele mecanice şi termice. Agent oxidant puternic; la contactul cu Mn 2 Se aprind aproximativ 7 substanţe combustibile. OXID DE MANGAN obţinut prin interacţiunea KMnO 4 cu H Z SO 4 la rece.
Oxidul Mn5O8, sau Mn2II (Mn IVO4)3, este un solid; insolubil în apă; poate fi obţinut prin oxidarea MnO sau Mn3O4; se descompune cu ușurință în MnO 2 și O 2.
Hidroxizi stoichiometrici de Mn compușii sunt doar Mn (OH) 2, MnO (OH) și HMnO 4, alții sunt hidratați. oxizi de compoziție variabilă, similare ca proprietăți chimice cu oxizii corespunzători. Proprietățile acide ale hidroxizilor cresc odată cu creșterea stării de oxidare a Mn: Mn (OH) 2< MnО(ОН) (или Mn 2 O 3 * xH 2 O) < MnO 2 * xН 2 О < Mn 3 О 4 * xН 2 О < Н 2 MnО 4 < НMnО 4 . Гидроксид Мn(II) практически не растворим в воде (0,0002 г в 100 г при 18 °С); основание средней силы; растворим в растворах солей NH 4 ; на воздухе постепенно буреет в результате окисления до MnО 2 * xН 2 О.
Hidroxidul de Mn (III) MnO (OH) este cunoscut în două modificări; la 250°C în vid se deshidratează la g -Mn 2 Aproximativ 3; în apă nu sol. Natural manganitul nu descompune HNO 3 și H 2 SO 4 diluat, ci reacționează lent cu H 2 SO 3, obținut artificial se descompune ușor cu acizii minerali; O2 este oxidat la b-MnO2. Vezi si Manganats.
OXIDUL DE MANGAN. toxic; MPC vezi art. Mangan.
Enciclopedie chimică. Volumul 2 >>
Metoda aluminotermă, reducerea oxidului Mn 2 O 3, format în timpul calcinării piroluzitului:;
Mn 6+ este disproporționat față de MnO 2 și MeMnO 4.
Mn 3+ este disproporționat față de Mn 2+ și MnO 2 (tv.)
Oxizi:
Oxizi cunoscuți de mangan, în care se află în stările de oxidare +2, +3, +4, +7, precum și mai mulți amestecați, de exemplu, Mn 3 0 4. Odată cu creșterea stării de oxidare, natura covalentă a legăturii Mn-O crește, proprietățile bazice și acide slăbesc, iar activitatea oxidativă crește. Astfel, oxidul de mangan (2) prezintă proprietăți reducătoare de bază și predominante, în timp ce oxidul de mangan superior are acid.
caracterul lotului. Are proprietăți oxidante pronunțate. Oxizii de mangan în stări intermediare de oxidare sunt amfoteri și se reduc cu ușurință la Mn (II), prezentând proprietățile agenților oxidanți puternici.
Oxid de mangan (2). Oxidul inferior MnO este o pulbere cristalină gri-verde cu o structură NaCl. Apare în mod natural sub formă de manganosit mineral. A lui
reactivitatea depinde de mărimea granulelor. Forma extrem de dispersată de oxid, formată în timpul descompunerii la temperatură scăzută (420 -450 ° C) a carbonatului, oxalatului sau acetatului de mangan (II), are activitate chimică semnificativă - se aprinde în aer. Calcinarea sa într-o atmosferă inertă duce la mărirea boabelor și la slăbirea activității chimice. Pentru a obţine o fază de compoziţie stoechiometrică, oxizii Mn 3 0 4 şi MnO 2 se reduc cu hidrogen la temperaturi ridicate. Oxidul de mangan inferior poate fi obținut și prin interacțiunea manganului
cu dioxid de carbon la o temperatură de 300 "C, reducerea sau calcinarea altor oxizi de mangan, precum și în timpul deshidratării hidroxidului de Mn (OH) 2 în atmosferă reducătoare la 800 ° C.
Oxidul de mangan (2) are un caracter predominant bazic. Se dizolvă ușor în acizi pentru a forma săruri bivalente de mangan. Amfoteritatea slabă se manifestă numai atunci când
fierbere lungă cu soluții alcaline concentrate:
MnO + 20H - + H 2 0 = 4 [Mn (OH) 4] 2- Fuziunea cu hidroxid de sodiu duce la oxidarea manganului: MnO + 2NaOH = Na 2 Mn0 3 + H 2
Oxidul de mangan (2) practic nu este redus de hidrogen, dar reacţionează cu metalele active. Reacția cu sodiu are loc deja la temperatura camerei, iar pentru efectuarea alumotermiei este necesară inițierea cu un amestec incendiar. Carbonul sau monoxidul de carbon pot fi, de asemenea, utilizați ca agent reducător.
Oxidul de mangan (2) este un agent reducător puternic - la temperaturi ridicate reacţionează chiar şi cu un agent oxidant atât de slab precum monoxidul de carbon (4).
Oxid de mangan (3). Oxidul de Mn 2 0 3 este maro
pulbere, care se descompune la încălzire. atunci când este depozitat în aer, se oxidează încet în oxid de mangan (4), iar în topitura eutectică NaOH-KOH (227 ° C) oxigenul îl transformă în
manganat (5). Oxidul de mangan (3) nu interacționează cu apa, dar este disproporționat într-un mediu acid.
Ca și oxidul de mangan inferior, are un caracter predominant de bază, dar în anumite condiții prezintă unele semne de amfoteritate. Astfel, în timpul fierberii prelungite cu soluții alcaline se formează hexahidroxomanganați anionici (3) [Mn (OH) 6] 3-, care există numai într-un mediu puternic alcalin. Mn 2 0 3 prezintă proprietăţi oxidante când este fiert cu acid clorhidric concentrat.
Oxid de mangan (4). Pentru mangan, acesta este cel mai frecvent mineral piroluzit MnO2 care apare în mod natural. Dintre numeroasele reacții pentru formarea Mn02, doar câteva sunt preferate datorită ușurinței lor de implementare și reproductibilitate. Acestea includ oxidarea compușilor de mangan (2) cu soluții de clorați, permanganat
nate, persulfați, clor și ozon, reducerea permanganaților prin acțiunea peroxidului de hidrogen, acidului clorhidric, dioxidului de sulf, sulfiților, alcoolilor, sărurilor de mangan (2). Majoritatea dioxidului de mangan este eliberat sub formă de precipitat maro, dar o parte din acesta rămâne sub formă de soluție coloidală. Dioxidul de mangan ca compus cu o stare intermediară de oxidare prezintă proprietăți oxidante și reducătoare. Comportamentul unui agent oxidant este mai tipic pentru acesta. Când este încălzit, are loc o reacție redox intramoleculară, însoțită de eliberarea de oxigen și o scădere treptată a stării de oxidare a manganului cu formarea secvențială a diferiților oxizi. Cu hidrogen sulfurat uscat, reacția are loc foarte rapid deja la temperatura camerei. Când hidrogenul sulfurat este trecut printr-o suspensie apoasă de MnO2, se formează un precipitat albicios, constând dintr-un amestec de sulfură de mangan (2) și sulf; soluţia conţine ioni S0 4- şi S 2 0 2-.
Proprietățile oxidante ale dioxidului de mangan sunt cele mai pronunțate într-un mediu puternic acid. Când dioxidul de mangan este tratat cu acid clorhidric concentrat la rece, rămâne o soluție închisă la culoare, care conține acidul complex H 2 [MnCl 6] și, eventual, tetraclorura MnCl 4, care nu a fost izolată în forma sa individuală. Soluția se luminează treptat datorită reducerii clorurii
complexe [МnС1 6] 2- - »[МnС1 6] 3- -> Mn 2+ + 6C1 - și evoluția clorului.
În acizii azotic și sulfuric diluat, MnO2 este insolubil; numai în timpul depozitării pe termen lung sub o soluție acidă, se observă o eliberare treptată a oxigenului datorită oxidării apei. Interacțiunea dioxidului de MnO2 cu alcalii are loc numai în soluții concentrate și topituri. În funcție de temperatura de reacție, raportul dintre reactivi, prezența sau absența oxidanților, de exemplu, oxigenul atmosferic, se formează oxomanganați anionici care conțin mangan în diferite stări de oxidare de la +3 la +6. De exemplu, interacțiunea dioxidului de mangan cu o soluție concentrată fierbinte de hidroxid de potasiu într-o atmosferă inertă formează mai întâi o soluție verde de manganat (4), care apoi se transformă într-o soluție albastru închis care conține cantități echimolare de manganat (5) și manganat ( 3). Când reacția este efectuată în aer la o temperatură de 350 - 450 ° C, se formează manganat (6), la o temperatură de 600 - 800 ° C, manganat (5).
Hidroxizi.
hidroxid de mangan (2), precipitat sub formă de precipitat alb (fildeș) sub acțiunea alcalinelor asupra soluțiilor apoase de săruri de mangan (2) în aer se oxidează rapid, prin urmare, sinteza acestuia se realizează într-o atmosferă inertă. Oxidanții mai puternici, cum ar fi apa cu brom și hipocloritul, îl transformă în piroluzit. Spre deosebire de majoritatea hidroxizilor metalelor de tranziție, hidroxidul
manganul (2) are o compoziție stoechiometrică corespunzătoare formulei Mn (OH) 2; este izostructural cu hidroxid de magneziu; este o bază de rezistență medie, superioară amoniacului, de aceea intră în soluție nu numai sub acțiunea acizilor, ci și în prezența ionilor de amoniu.
Caracterul amfoter slab al hidroxidului de Mn (2) se manifestă prin capacitatea sa de a forma hidroxocomplecși anionici: Mn (OH) 2+ OH -<->[Pt (OH) 3] -
Hidroxid de mangan (3) se formează sub formă de precipitat brun de compoziție variabilă în timpul oxidării hidroxidului de mangan (2) cu oxigenul atmosferic. Produsul format inițial conține atomi de mangan în două stări de oxidare: +2 și +3 - și corespunde compoziției MnOx * nH 2 0.
În picioare, se transformă în forma oxohidroxidului MnOOH, cunoscut sub formă de două modificări: rombic (y-MnOOH, manganit) și monoclinic (a-MnOOH, growit). Oxihidroxidul de mangan (3) este amfoter.
Sare.
O varietate de săruri se obțin prin interacțiunea hidroxidului de mangan (2) cu acizii. Spre deosebire de hidroxid, toate sunt rezistente la oxidarea de către oxigenul atmosferic.
Săruri de mangan (2) formează hidrați, colorați într-o culoare roz pal, caracteristic cationilor [Mn (H 2 0) 6] 2+. Ele fac parte din unii hidrați, de exemplu MnS0 4 * 7H 2 0, Mn (C10 4) 2 * 6H 2 0, Mn (N0 3) 2 * 6H 2 0. În soluțiile apoase de săruri de mangan (2), are loc hidroliza : [Mn (H 2 0) 6] 2+ + H 2 0 = [Mn (H 2 0) 5 OH] + + H 3 0 +
Acţiunea sulfiţilor de metale alcaline asupra soluţiilor de sare de mangan duce la precipitarea sărurilor bazice, de exemplu NaMn 2 OH (S0 3) 2 (H 2 0).
Când ionii Mn 2+ sunt precipitați prin soluții de sulfură, se formează un precipitat de sulfură de mangan hidratată (2) MnS * xH20 de culoarea cărnii. Deși structura cristalină a acestui produs este necunoscută, culoarea roz pal sugerează că moleculele de apă completează sfera de coordonare a manganului la un octaedru. La depozitarea în aer, precipitatul se oxidează treptat, transformându-se în oxohidroxid brun MnOOH, iar în atmosferă inertă pierde apa de cristalizare, căpătând culoarea verde caracteristică mineralului natural alabandin (α-MnS), care are o structură.
tur ca NaCl. Acționând asupra unei soluții de sare de mangan cu dihidrogenofosfat de sodiu într-un mediu apropiat de neutru, este posibil să se precipite un precipitat alb de ortofosfat mediu Mn 3 (P0 4) 2 * 7H 2 0.
Într-un mediu alcalin, sărurile bazice sunt precipitate, de exemplu, Mn2(OH)PO4, Mn5(OH)4(PO4)2.
Sunt cunoscuți și diverși fosfați acizi, de exemplu Mn (H 2 P0 4) 2 * H 2 0, foarte solubil în apă și MnHPO 4 * H 2 0 slab solubil. Când sărurile de mangan (2) sunt expuse la o soluție de sodiu carbonat, se eliberează un precipitat alb de carbonat MnCO 3 care conține doar o cantitate mică de sare bazică. Pentru a evita formarea acestuia, precipitarea se efectuează cu bicarbonat.
Săruri de mangan (3)
Când MtOOH este dizolvat la rece în acid sulfuric 70%, se formează o soluție roșie, din care pot fi izolate cristale roșii. Cea mai comună metodă de obținere a sărurilor de mangan (3) este transformarea redox. Deci, sulfatul de mangan (3) este sintetizat prin oxidarea anodică a unei soluții fierbinți de sulfat de mangan (2) în acid sulfuric sau prin reducerea permanganatului de potasiu cu acid sulfuric:
2KMn0 4 + 4H 2 S0 4 = Mn 2 (S0 4) 3 + K 2 S0 4 + 20 2 + 4H 2 0
Săruri anorganice de mangan (4) extrem de instabil si putin studiat. Astfel, sulfatul de mangan (4) Mn (SO 4) 2 este eliberat sub formă de cristale negre din soluții suficient de concentrate de acid sulfuric de sulfat de mangan (2) atunci când li se adaugă permanganat de potasiu.
Săruri de mangan (6).
Pentru prima dată, manganații (6) au fost pregătiți de I. Glauber în
1659 prin dizolvarea piroluzitei în salpetru topit. Aceste substanțe sunt cristale de culoare verde închis, aproape negre, solubile în soluții alcaline pentru a forma soluții de verde smarald.
În soluții neutre și slab acide, manganații sunt ușor dispersați
porționat, care se apreciază după precipitarea unui precipitat maro închis de dioxid și apariția unei culori purpurie a soluției. Pentru a accelera procesul, dioxidul de carbon este de obicei trecut prin soluție. Dintre manganați, cea mai importantă este sarea de potasiu K 2 Mn0 4, care servește la producerea de permanganat KM p 04. În condiții de laborator, este convenabil să se obțină manganați de metale alcaline.
oxidarea apei cu permanganat într-o soluție puternic alcalină. Pentru aceasta, permanganatul este plasat într-o soluție concentrată de alcali și încălzit.
Dioxidul de mangan (MnO 2) sau oxidul de mangan (IV) este o substanță de culoare gri închis. Când este încălzit în aer până la 530 de grade. Dioxidul de mangan se descompune cu oxigen, așa cum se arată mai sus. În vid sau în prezența unui agent reducător, această reacție decurge mult mai intens.
Când dioxidul de mangan este fiert cu acid azotic concentrat, se formează o sare de mangan (II) și se eliberează oxigen:
2 MnO 2 + 4 HNO 3 = 2 Mn (NO 3) 2 + 2 H 2 O + O 2.
Dioxidul de mangan într-un mediu acid prezintă proprietăți oxidante:
Mn02 + 4 HCI = MnCI2 + CI2 + 2 H20;
МnО 2 + 2 FeSO 4 + 2 Н 2 SO 4 = МnSO 4 + Fe 2 (SO 4) 3 + 3 Н 2 О.
Când oxidul de mangan (IV) este fuzionat cu alcalii fără acces la aer, se formează manganit sau manganat (IV):
2 MnO 2 + 2 KOH = K 2 MnO 3 + H 2 O.
În prezența oxigenului atmosferic, care joacă rolul unui agent oxidant, în timpul fuziunii se formează o sare manganat (VI):
2 МnО 2 + 4 KOH + O 2 = 2 К 2 МnО 4 + 2 Н 2 О.
Manganatul de potasiu (K 2 MnO 4) se descompune spontan în permanganat de potasiu și dioxid de mangan:
3 К 2 МnО 4 + 2 Н 2 О = 2 КМnО 4 + МnО 2 + 4 KOH.
Permanganatul de potasiu (KMnO 4) este utilizat pe scară largă în practica de laborator, industrie, medicină și viața de zi cu zi. Este un agent oxidant foarte puternic. În funcție de mediu, manganul în prezența unui agent reducător poate fi redus la diferite stări de oxidare. Într-un mediu acid, se reduce întotdeauna la Mn (II):
2 КМnО 4 + 10 КВr + 8 Н 2 SO 4 = 2 МnSO 4 + 6 К 2 SO 4 + 5 Вr 2 + 8 Н 2 О.
Manganatul de potasiu (K 2 MnO 4) și dioxidul de mangan se comportă în mod similar.
Într-un mediu alcalin, permanganatul de potasiu este redus la manganat:
2 KMnO 4 + K 2 SO 3 + 2 KOH = K 2 SO 4 + 2 K 2 MnO 4 + H 2 O.
Într-un mediu neutru sau ușor alcalin, permanganatul de potasiu este redus la dioxid de mangan:
2 KMn04 + C6H5CH3 = 2 KOH + 2 MnO2 + C6H5COOH;
2 КМnО 4 + 3 МnSO 4 + 2 Н 2 О = 5 МnО 2 + К 2 SO 4 + 2 Н 2 SO 4.
Ultima reacție este utilizată în chimia analitică pentru determinarea cantitativă a manganului.
Anterior, permanganatul de potasiu era obținut prin oxidarea fie a dioxidului de mangan, fie a manganatului de potasiu. Dioxidul de mangan a fost oxidat cu nitrat prin fuziune cu alcali:
MnO 2 + KNO 3 + 2 KOH = K 2 MnO 4 + KNO 2 + H 2 O.
Manganatul de potasiu rezultat în soluție s-a descompus spontan în permanganat de potasiu și dioxid de mangan:
3 К 2 MnО 4 + 2 Н 2 О = 2 КМnО 4 + MnО 2 + 4 KOH.
Conform celei de-a doua metode, manganatul de potasiu a fost oxidat cu clor:
2 К 2 МnО 4 + Сl 2 = 2 КМnО 4 + 2 КСl.
În prezent, permanganatul de potasiu se obține prin oxidarea electrolitică a manganatului:
Mn042- - e - = Mn04-.
Permanganatul de potasiu este utilizat pe scară largă atât în industrie, cât și în practica de laborator. Este folosit pentru albirea bumbacului, a lânii, a fibrelor de filare, a ușura uleiurile și a oxida diferite substanțe organice. În practica de laborator, se folosește pentru obținerea de clor și oxigen:
2 KMn04 + 16 HCI = 2 KCI + 2 MnCl2 + 5 CI2 + 8 H20;
2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2.
În chimia analitică, permanganatul de potasiu este utilizat pentru determinarea cantitativă a substanțelor cu proprietăți reducătoare (Fe 2+, Sn 2+, AsO 3 3+, H 2 O 2 etc.). Această metodă de analiză se numește permanganatometrie.